La enfermedad cardiovascular (ECV) es la principal causa de mortalidad en el mundo, y la mayoría de las muertes por ECV ocurren como consecuencia del infarto de miocardio o cerebrovascular. La principal causa subyacente de la trombosis y los eventos cardiovasculares es la aterosclerosis, una enfermedad inflamatoria que puede permanecer asintomática durante largos períodos de tiempo. Por ello, existe una necesidad urgente de opciones terapéuticas y de diagnóstico en esta área. Se sabe desde hace mucho tiempo que las placas ateroscleróticas contienen autoanticuerpos y existe una conexión bien aceptada entre la aterosclerosis y la autoinmunidad. Sin embargo, todavía no se conocen en detalle los desencadenantes de la respuesta (antígenos) ni el impacto de esta respuesta en el desarrollo de la enfermedad.
En nuestro laboratorio hemos realizado por primera vez un estudio extenso del repertorio de anticuerpos asociado a la enfermedad aterosclerótica. Así, hemos secuenciado más de 1700 anticuerpos de linfocitos B individuales y hemos podido identificar una colección de 56 clones de anticuerpos. De ellos, 18 reconocen la placa aterosclerótica, lo que indica que su especificidad está relacionada con esta enfermedad. Mediante un análisis proteómico de alta profundidad pudimos establecer que uno de estos anticuerpos, que hemos denominado A12, reconoce una proteína del propio organismo, llamada (ALDH4A1), una deshidrogenasa mitocondrial involucrada en el metabolismo de la prolina. Hemos encontrado que la distribución de ALDH4A1 se altera durante la aterosclerosis y que los niveles de ALDH4A1 en plasma están aumentados en ratones y humanos con aterosclerosis. Estos resultados sugieren que ALDH4A1 podría utilizarse como biomarcador de la enfermedad. Por otra parte, el tratamiento de ratones ateroscleróticos con el anticuerpo A12 retrasa la formación de placa y reduce los niveles de colesterol libre y LDL, lo que indica que los anticuerpos anti-ALDH4A1 pueden desempeñar un papel protector en la progresión de la aterosclerosis y podrían tener potencial terapéutico. En conjunto, estos estudios han desvelado un antígeno asociado a la aterosclerosis que puede constituir una nueva diana para intervenciones diagnósticas y terapéuticas en las ECV.
Este trabajo se ha realizado en colaboración con Hedda Wardemann (Deutsches Krebsforschungszentrum. Alemania), Jesús Vázquez (CNIC y CIBERCV) y Jose Luis Martín-Ventura (FIIS Fundación Jiménez-Díaz y Universidad Autónoma de Madrid) y ha contado con la financiación del Ministerio de Economía y Competitividad (SAF2016-75511-R) y de la Fundación La Caixa (HR17-00247). Los resultados se han publicado en la revista Nature (ALDH4A1 is an atherosclerosis auto-antigen targeted by protective antibodies, 10.1038/s41586-020-2993-2) y han recibido el premio Ciencias de la Salud de la Fundación Caja Rural de Granada en 2021.
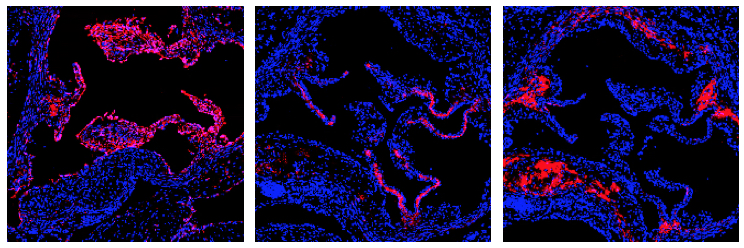
El proyecto financiado por el Programa de I+D+i Retos (PID2019-106773RB-I00) incluye entre sus objetivos la caracterización de especificidades de los anticuerpos identificados en asociación con la aterosclerosis, mediante estudios proteómicos para identificar antígenos específicos. Asimismo, se profundizará en los mecanismos ateroprotectores (A12) o aterogénicos de estos anticuerpos, mediante ensayos funcionales similares a los que se ha descrito. Por otra parte, el carácter ateroprotector de A12 sugiere que ALDH4A1 podría ser un candidato interesante para desarrollar estrategias de vacunación. Por ello, en nuestro proyecto planteamos también estudiar la respuesta inmune a ALDH4A1 y otros antígenos. Finalmente, nuestro proyecto profundizará en el potencial de ALDH4A1 como biomarcador de la progresión aterosclerótica mediante análisis de sueros procedentes de cohortes de pacientes, así como del estudio Progression of Early Subclinical Atherosclerosis (PESA CNIC-Santander).


Almudena Rodríguez Ramiro recibió su Doctorado y Premio Extraordinario en la Universidad Autónoma de Madrid en 2000. Ramiro realizó su formación postdoctoral en el grupo de Michel Nussenzweig en la Universidad Rockefeller (Nueva York, EE. UU.) (2001-2005). En esta etapa, Ramiro estudió la función de la Desaminasa Inducida por Activación (AID) en la diversificación de anticuerpos (Ramiro et al., Nat Immunol 2003; Ramiro et al., Cell 2004; Ramiro et al., Nature 2006).
En 2006 Ramiro se incorporó como Jefe de Grupo en el Centro Nacional de Investigaciones Oncológicas (CNIO), y en 2012 se trasladó al Centro Nacional de Investigaciones Cardiovasculares (CNIC), donde dirige el Laboratorio de Biología de Linfocitos B. Ramiro estudia los microRNAs en la función de los linfocitos B y la linfomagénesis B (de Yébenes et al., J Exp Med 2008, Belver et al., Immunity 2010, de Yebenes et al., Blood 2014, Bartolomé et al Blood 2017) y los mecanismos reguladores de la actividad de AID (Perez-Duran et al., J Exp Med 2012, Pérez-García et al EMBO Mol Med 2015, Alvarez-Prado et al, 2018, Delgado et al PLOS Genetics 2021). Recientemente, el laboratorio de Ramiro ha encontrado un nuevo antígeno asociado a la aterosclerosis (Lorenzo et al, Nature 2021).
Ramiro recibió financiación del programa ERC Starting Grant en 2007 y del programa ERC Proof of Concept en 2015. En 2018 recibió financiación del programa Health Research de la Fundación la Caixa. Ramiro recibió el premio Biogen Idec a JóvenesInvestigadores en 2006 y el Premio Banc Sabadell a la Investigación Biomédica en 2013. En 2021 fue galardonada con el Premio Ciencias de la Salud Fundación Caja Rural Granada.


